Iván El Salvador
Etiquetas
jueves, 19 de junio de 2025
Nuevo estado de la materia: Supersólido
lunes, 16 de junio de 2025
Repaso último día de clase biología 3º ESO
Realizar los siguientes 2 tests y apunta el resultado como: "Número de aciertos/Número de preguntas".
domingo, 15 de junio de 2025
Repaso últimos días de clase de biología 1º ESO
https://es.educaplay.com/recursos-educativos/1181776-los_invertebrados_1.html
https://es.educaplay.com/recursos-educativos/656225-la_atmosfera.html
https://es.educaplay.com/recursos-educativos/7310277-hidrosfera.html
https://es.educaplay.com/recursos-educativos/1292069-los_vertebrados.html
https://es.educaplay.com/recursos-educativos/6247782-bacterias.html
miércoles, 11 de junio de 2025
Reinos en la naturaleza
Los reinos de la naturaleza:
Hoy vamos a visionar un video del Reino Fungi y contestaremos a las siguientes preguntas:
2.- ¿Cuántas especies de hongos se han descrito y cuántas se estima que existen en total?
3.- ¿De qué está hecha la pared celular de los hongos?
4.- ¿En qué tipos de hábitats se pueden encontrar los hongos?
5.- ¿Cuál es el papel crucial de los hongos en los bosques?
6.- ¿Qué tipo de relación simbiótica forman los hongos con las raíces de las plantas?
7.- ¿Cuál fue el primer antibiótico descubierto y de qué hongo proviene?
8.- Menciona algunos ejemplos de medicamentos derivados de hongos.
9.- ¿Cómo contribuyen los hongos a la gastronomía?
10.- ¿Qué hongos son esenciales para la fermentación del pan, la cerveza y el vino?
11.- ¿Qué problemas de salud pueden causar algunos hongos en los humanos?
12.- ¿Qué son las micotoxinas y por qué son peligrosas?
13.- ¿Cómo afectan las enfermedades fúngicas a la agricultura?
14.- ¿De qué manera los hongos pueden dañar los edificios?
15.-¿Qué potencial tienen los hongos para un futuro sostenible?
sábado, 7 de junio de 2025
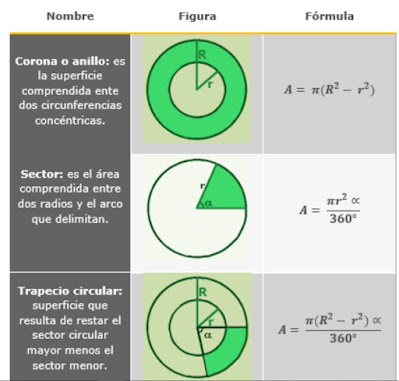
A continuación tenemos una serie de figuras planas sobre las que tendremos que calcular sus áreas y perímetros:
Por aquí dejamos una explicación de por qué a algunos cuerpos les llamamos cuerpos de revolución y de qué figura parten:
miércoles, 4 de junio de 2025
Reproducción humana y gestación
A continuación tenemos 3 enlaces a un documental de Discovery Channel, donde nos explica en qué consiste la gestación y parto en los humanos:
Preguntas de comprensión general
-
¿Qué ocurre durante la fecundación?
-
¿Dónde se encuentra el óvulo cuando es fecundado por el espermatozoide?
-
¿Cuántos días tarda el embrión en llegar al útero?
-
¿Qué es la implantación y por qué es importante?
-
¿Cómo se llama el saco que protege al embrión durante el embarazo?
Preguntas sobre el desarrollo del feto
-
¿Cuándo empieza a latir el corazón del embrión?
-
¿Qué órganos se empiezan a formar durante las primeras semanas?
-
¿Qué función tiene la placenta?
-
¿Qué es el cordón umbilical y para qué sirve?
-
¿Por qué el líquido amniótico es importante para el desarrollo del bebé?
Preguntas relacionadas con la madre
-
¿Qué cambios sufre el cuerpo de la madre durante el embarazo?
-
¿Por qué es importante la alimentación de la madre durante el embarazo?
-
¿Cómo ayuda el sistema hormonal a mantener el embarazo?
Reflexión y ampliación
-
¿Qué cuidados debe tener una mujer embarazada para proteger al bebé?
-
¿Por qué es importante conocer cómo se forma y desarrolla un ser humano?
Preguntas de comprensión general
-
¿Cuántas calorías adicionales necesita una mujer embarazada diariamente y por qué es importante este aumento?
-
¿Qué efectos puede tener el consumo de tabaco durante el embarazo en el desarrollo del feto?
-
¿Cómo afecta el consumo de alcohol al desarrollo del cerebro y otros órganos del feto?
-
¿En qué semana del embarazo se pueden empezar a distinguir los órganos sexuales del feto?
-
¿Qué cambios experimenta la piel del feto a medida que avanza el embarazo?
Preguntas sobre el desarrollo fetal
-
¿Qué es el surfactante y cuál es su función en los pulmones del feto?
-
¿A partir de qué semana el feto comienza a percibir sonidos del exterior, como la voz de la madre?
-
¿Cómo se desarrollan los órganos sexuales del feto y cuándo se pueden distinguir?
-
¿Qué cambios experimenta la piel del feto a medida que avanza el embarazo?
-
¿Qué son las contracciones de Braxton Hicks y cómo se diferencian de las contracciones del parto?
Preguntas relacionadas con la madre
-
¿Por qué se recomienda que, después de las 20 semanas, la madre evite acostarse de espaldas?
-
¿Cómo afecta el crecimiento del útero a la respiración y circulación de la madre?
-
¿Qué efectos pueden tener el tabaco y el alcohol en el desarrollo del feto?
-
¿Por qué es importante que la madre aumente su ingesta calórica durante el embarazo y cuántas calorías adicionales necesita aproximadamente?
-
¿Qué cambios sufre el cuerpo de la madre durante el embarazo?
jueves, 29 de mayo de 2025
Energía cinética, potencial y mecánica.
lunes, 19 de mayo de 2025
¿Para qué sirven los logaritmos?


Utilizando la definición de logaritmo, calcula los siguientes:






miércoles, 7 de mayo de 2025
VII Feria de minerales en Torrelavega
martes, 6 de mayo de 2025
The atmosphere
a) Write the names of the different layers n the correct order (0,5 points)
b) What is the reason that in the thermosphere the temperature increase with the altitude? (0,5 points)
c) What is the reason that in the stratosphere the temperature increase with the altitude? (0,5 points)
d) Calculate how thick is each layer. (0,5 points)
e) What is the layer that the planes use to fly? (0,5 points)
f) Inside which layer you can find the ozone layer? What is this layer for? (0,5 points)
g) What is the difference between Troposphere and Tropopausa? (0,5 points)
h) What is the other name of the layer called Thermosphere? (0,5 points)
Brisa diurna y brisa nocturna




























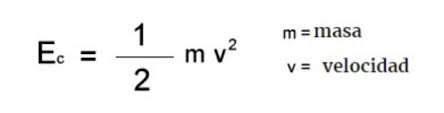












_0.png)