Cálculo de Masa Molar
Calcula la masa molar de H2SO4:
M (H2SO4) = 2 · M (H) + M (S) + 4 · M (O) = 2 · 1,008 + 32,065 + 4 · 15,999 = 98,077 gramos / mol.

Ejercicio: Se tiene una disolución que se ha preparado disolviendo 23,4 g de sulfato de sodio (Na2SO4(s)) en agua hasta completar 0,5 libros de disolución. ¿Cuál es su concentración molar? (Masas atómicas Na: 23 g/mol, S: 32 g/mol y O: 16 g/mol)
M (Na2SO4) = 23*2 + 32 +16*4= 46 +32 + 64 = 142 g/mol
n = 23,4/ 142 = 0,164 moles de sulfato de cobre.
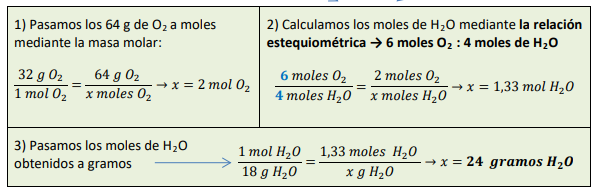
Reacción química:
2Mg (s) + O2 (g) 👉 2MgO(s)
La reacción nos diría 2 moles de Mg reaccionan con 1 mol de O2 obteniendo 2 moles de MgO, pero en nuestro caso no reaccionan 48 gramos de Mg, sino 6 g, por lo que tendremos que calcular los moles de cada sustancia.
Entonces 0,25 moles de Mg reaccionan con 0,125 moles de O2 obteniendo 0,25 moles de MgO.
Aplicando la fórmula anterior podemos calcular la masa de O2 y de MgO, que serán 4 g y 10 g respectivamente.
En caso de no encontrarnos en condiciones normales, podemos utilizar la Ley de los Gases Ideales:
Un mol de cualquier gas, en condiciones normales, ocupa 22,4 litros y contiene
6,022 × 1023 partículas (átomos, moléculas¿).











No hay comentarios:
Publicar un comentario