Video en castellano sobre los vertebrados:
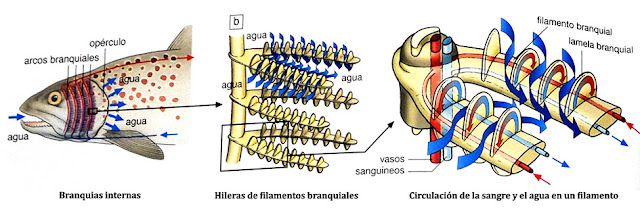
Fish
We are going to talk about the seahorses:
Metamorphosis from of a tadpole to from
Birds
Platypus
1.- How many animals are combined in the platypus?
2.-The platypus is the same size as another rodent, which one is it?
3.- What does the name platypus mean?
4.- Where does the platypus live?
5.- What does it use its wide beak for?
6.- Platypuses have very sensitive skin, with it they can notice the vibrations of what animals?
7.- Do both sexes have spurs? Do they have them all their lives?
8.- The poison that platypuses can inject is composed of how many substances?
9.- What effects does a platypus bite produce?
Identify the next fishes if they are bony or cartilaginous fish:
Manta.
Salmón.
Anguila.
Lubina.
Tiburón blanco.
Tiburón vaca
Bony fish:
Cartilaginous Fish